Základní poznatky molekulové fyziky
Molekulová fyzika a termika
- studují vlastnosti látek
Termika (Termodynamika) se zabývá měřením teploty a tepla a tepelnými ději
Molekulová fyzika se zabývá silami mezi částicemi a strukturou látek.
Vlastnosti látek pozorujeme:
1) Termodynamicky – z makroskopického hlediska, nebereme v úvahu částicové složení látek. Pracujeme s veličinami, které lze změřit nebo odvodit.
2) Statisticky - z hlediska mikrosvěta - každé těleso se zkoumá jako soubor neustále se pohybujících částic. Zákony, ke kterým se dospěje, mají statistický charakter.
Zkoumané těleso nebo soustavu těles nazýváme termodynamická soustava.
Kinetická teorie látek
1) Látky všech skupenství se skládají z částic (atomů, molekul, iontů) o rozměrech řádově 10–10 m. Struktura látky je tedy nespojitá.
2) Částice se v látkách neustále a neuspořádaně (chaoticky) pohybují = tepelný pohyb
Pokud je těleso v klidu, nepřevládá žádný směr. Pokud je těleso v pohybu, pohybují se také všemi směry, ale převládá pohyb ve směru pohybu celého tělesa.
Tepelný pohyb potvrzuje:
difúze (samovolné pronikání částic jedné látky mezi částice druhé látky, jsou-li tělesa z těchto látek uvedena do vzájemného styku – šíření vůně, ale i zápachu, rozpouštění cukru)
tlak plynu (způsoben srážkami molekul plynu s částicemi stěny nádoby)
Brownův pohyb (když nasypeme zrnka pylu na vodní hladinu, budou se po ní neuspořádaně pohybovat - způsobeno nárazy molekul vody na zrnka). Protože se částice pohybují, mají kinetickou energii.
3) Částice na sebe navzájem působí přitažlivými a odpudivými silami. Velikost těchto sil závisí na vzdálenosti mezi částicemi.
Když se k sobě přibližují dva atomy, elektrickou silou na sebe působí kladně nabitá jádra a záporně nabité obaly. Mezi atomy na sebe zároveň působí gravitační síly. Síla, kterou na sebe působí, je při malých vzdálenostech odpudivá, při větších je přitažlivá.
r > r0 - přitažlivá síla,zpočátku rychle roste, pak dosáhne maxima a s rostoucí vzdáleností se zmenšuje
r < r0 - odpudivá síla,zpočátku rychle roste, pak dosáhne na tzv. potencionální val = hranice přiblížení molekul = poloměr molekuly 10–10 m. Dotknout se mohou jen za teploty kolem 106 K.
rovnovážná poloha - částice jsou ve vzdálenosti r0 a velikost síly, kterou na sebe působí, je nulová, kolem ní kmitají.
Při velké vzdálenosti je síla již zanedbatelně malá. Každá částice je přitahována jen nejbližšími částicemi ve svém okolí – pro kapaliny se přitažlivé působení projevuje asi do vzdálenosti 1 nm, přičemž r0 vody je 0,3 nm.
Energie, kterou má částice kvůli své poloze vůči sousední pro působící sílu, je potenciální energie.
Vnitřní energie tělesa (soustavy) je součet celkové kinetické energie všech neuspořádaně se pohybujících částic tělesa a celkové potenciální energie vzájemné polohy těchto částic.
Pevné látky: částice kmitají málo, proto mají malou kinetickou energii a při malém vychýlení získají velkou potenciální energii => Ep >> Ek.
Kapaliny: částice kmitají více, ale nemohou se hodně vzdálit z těchto rovnovážných poloh => Ep > Ek.
Plyny: částic plynu už se nemusí uvažovat s rovnovážnou polohou, protože se pohybují ve velkých vzdálenostech od ostatních částic a velkou rychlostí => Ep << Ek.
Celková energie tělesa (soustavy) je součet její mechanické a vnitřní energie. Celková energie soustavy se nemění. Ztráty způsobené třením jsou způsobeny přeměnou mechanické energie na vnitřní energii.
Stavy soustav
Těleso nebo termodynamická soustava se může nacházet v různých stavech
stavové veličiny: teplota T[K], tlak p[Ps], objem V[m3].
izolovaná soustava = mezi soustavou a okolím nedochází k výměně energie ani výměně částic
termodynamický děj = stavová změna = dochází ke stavové změně soustavy (konáním práce nebo tepelnou výměnou)
Každá soustava, která je od určitého okamžiku v neměnných vnějších podmínkách, přejde samovolně po určité době do rovnovážného stavu. V tomto stavu setrvává, pokud zůstanou tyto podmínky zachovány. Při rovnovážném stavu se nemění hodnoty stavových veličin.
Všechna tělesa, která tvoří rovnovážnou soustavu, mají stejnou teplotu.
Když například vložíme do mrazničky vodu, podmínky v mrazničce se nemění. Voda přechází do rovnovážného stavu pro podmínky v mrazničce, a za stavu v ledničce se voda vyskytuje ve skupenství pevném – ledu. Po zmrznutí vody a ochlazení ledu na teplotu okolí se už stav ledu nemění – led může v mrazničce zůstat třeba půl roku a nijak se nezmění. Ale když otevřeme mrazničku, změní se vnější podmínky, a změní se i rovnovážný stav ledu – může roztát.
Teplota
= fyzikální veličina, která charakterizuje termodynamický stav tělesa.
Termodynamická teplota T je jednou ze základních veličin soustavy SI. [T] = K (kelvin);
0,1 C = 273, 15 K => 0 K (-273,16 C) je teplota absolutní nuly (nemůže nikdy nastat, lze se k ní jen přiblížit)
- kelvin je definován podle trojného bodu vody = 273,16 K a nenabývá záporných hodnot.
definice: 1 K je teplota, která odpovídá 1/273,16 termodynamické teploty trojného bodu vody.
V praxi se setkáváme s Celsiovou teplotou t. Jednotka °C (stupeň Celsia) má stejnou velikost jako kelvin, ale 0 °C odpovídá 273,15 K. 0 °C je teplota tání ledu za normálního tlaku 1013,25 hPa, 100 °C je teplota varu vody za normálního tlaku.
Změna teploty je stejná v obou stupnicích. ΔT = Δt
Teploměr
- slouží k měření teploty, je to srovnávací těleso, u něhož známe jeho vlastnosti v závislosti na teplotě (objem kapaliny – lihový, rtuťový teploměr; tlak plynu při stálém objemu – plynový teploměr → nejpřesnější, má velký rozsah (kapaliny jen od teploty tání po teplotu varu); změna délky v závislosti na teplotě – bimetalový teploměr; odpor – odporový teploměr; při velmi vysokých teplotách se využívá záření látky – pyrometr). Při měření teploty je teploměr v rovnovážném stavu s tělesem, jehož teplotu měříme, proto musíme čekat, než se dostane do rovnovážného stavu.
Vnitřní energie
- definice výše: Vnitřní energie tělesa je přímo úměrná jeho termodynamické teplotě.
- značí se U, platí zákon o zachování energie
U = Ep + Ek - není v tab, ale je logický
Když probíhá termodynamický děj, má soustava na jeho počátku vnitřní energii U1, při konečném stavu vnitřní energii U2; děj charakterizuje změna vnitřní energie soustavy DU = U2 – U1.
Změna vnitřní energie:
1) Konáním práce - Práci W může konat těleso působící na soustavu (W > 0 → práce se dodává soustavě) – píst stlačí plyn, nebo práci vykonává soustava (W < 0 → práce se soustavě odebírá) – píst se posune rozpínáním plynu.
Př. 49/1 :
F = 20N
s = 0.7 m
delta U = 10 F s = 10 * 20 * 0.7 = 140 J
delta U = m g h [J]
2) Tepelné výměně = předávání vnitřní energie, aniž by se konala práce. Těleso s vyšší teplotou předává energii tělesu s nižší teplotou.
K tepelné výměně může dojít:
a) Vedením – tepelné vodiče - pevné látky, které vedou tepelnou energii - částice se postupně rozkmitávají (hrnec, kovy)
Výbornou tepelnou vodivost mají kovy, proto když se dotkneme kovového tělesa, jeví se nám studené – teplo, které mu dodáme, je rychle odvedeno od celého tělesa; opak - dřevěná židle. Velmi špatnou tepelnou vodivost má voda a plyny (také sypké a pórovité látky, které mají uvnitř vzduch – peří, tkaniny, suché dřevo, cihly, skelná vata - užití ve stavebnictví). Látky špatně vodivé teplo se nazývají tepelné izolanty (plyn. v oknech, svetr)
b) Prouděním – Dojde k němu, zahříváme-li kapalinu nebo plyn zdola. Teplejší kapalina má menší hustotu, proto stoupá vzhůru a přenáší teplo do chladnějších míst. Tohoto se využívá nejvíce u vaření.
c) Zářením – světlo může předat část své energie látce, na kterou dopadne. Nejvíce energie přijme matné, černé těleso. Nejméně lesklé předměty
Když dané těleso teplo přijme → Q > 0, když teplo předá → Q < 0.
Velikost přijatého či odebraného tepla je přímo úměrná hmotnosti tělesa m a změně teploty tělesa Dt, pokud se nemění skupenství látky.
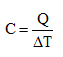 Množství tepla, které se musí danému tělesu dodat,
aby se jeho teplota zvětšila o 1 K, je jeho tepelná kapacita
C. [J × K–1]. (verze bez m není v tab)
Množství tepla, které se musí danému tělesu dodat,
aby se jeho teplota zvětšila o 1 K, je jeho tepelná kapacita
C. [J × K–1]. (verze bez m není v tab)
Měrná tepelná kapacita = tepelná kapacita 1 kg látky = Množství tepla, které se musí dodat tělesu o hmotnosti 1 kg, aby se jeho teplota zvětšila o 1 K, je jeho měrná tepelná kapacita c. [c] = J × K–1 × kg–1
![]()
voda: c = 4180 J kg−1 K−1
měď: c = 890 J kg−1 K−1
Z toho vyvodíme:
![]()
Teplo Q, které se musí dodat tělesu o hmotnosti m
z látky o měrné teplené kapacitě c, aby se ohřálo o teplotu
Δt
Měrná tepelná kapacita závisí na látce. Měrné tepelné kapacity různých látek jsou v tab. str. 131, 152.
Kalorimetrická rovnice
- vyjadřuje zákon zachování energie při tepelné výměně. Tělesa na konci děje dosáhnou rovnovážného stavu, tzn. mají stejnou teplotu
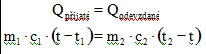
(v tab navíc započítána C – kapacita kalorimetru)
t2 > t1 - počáteční teploty těles; t je výsledná teplota; levá strana patří chlad. tělesu
Př. : mosazné těleso o hmotnosti 400g a teplotě 90 C vložíme do vody o hmotnosti 600g a teplotě 20 C.
c1 = 4180 J kg^-1K−1
c2 = 387 J kg−1 K−1
4180 * 0.6 (t - 20) =387 * 0.4 (90 - t)
2662.8 t = 64 092
t = 24 C
Kalorimetr = přístroj na měření tepla. umožňuje pokusně provádět tepelnou výměnu mezi tělesy a měřit teplotu. Izoluje okolí s kapalinou uvnitř. (termoska)
- 2 do sebe vložené nádobky, izolant mezi stěnami, víko - vkládá se teploměr
kapacita kalorimetru : ck = (m2c2(t2 - t) - m1c1 (t - t1)) / (t - t1) ß vyjádření C z tab
První termodynamický zákon
Celková změna vnitřní energie soustavy DU se rovná součtu práce W vykonané okolními tělesy nebo soustavou silovým působením a tepla Q přijatého z okolních těles nebo odevzdaného okolním tělesům.
ΔU = W + Q
Teplotní roztažnost
Nejen plyny, ale i pevné látky a kapaliny reagují na zvětšení teploty zvětšením vnitřní energie a tím zvětšením energie pohybu molekul. To se projeví tím, že molekuly mají větší rozkmit kolem rovnovážné polohy. Když tedy molekuly mají větší rozkmit, jsou celkové rozměry tělesa také větší.
Když těleso o délce l0 ohřejeme o teplotu Δt, bude jeho výsledná délka:
l = l0 * (1 + a * Δt)
Δl = l0 × a × Δt
a je součinitel teplotní délkové roztažnosti pevných látek (tab. str. 131) [a] = K–1
Pro objemovou roztažnost platí:
Změna objemu:
V = V0 × (1 + 3 × a × Δt)
V = V0 × (1 + b × Δt)
b = 3 × a; beta…. Součinitel objemové teplotní roztažnosti; str. 131
b [ K–1] je součinitel teplotní objemové roztažnosti kapalin (tab. str. 149)
Většina látek má β > 0 -> se vzrůstající teplotou se zvětšuje objem látky a klesá její hustota.
Objem vody při zahřívání z 0 °C nejprve klesá, až od 3,98 °C začne růst → anomálie vody; umožňuje přežít rybám přes zimu.
Lze zde využít otázku 10
Pro odvození vlastností částic používáme hmotnostní číslo + látkové množství
- Konstanty na 185
Hmotnostní číslo
Nukleonové číslo (též hmotové číslo nebo hmotnostní číslo) představuje celkový počet nukleonů v atomovém jádře. Nukleonové číslo je důležitou charakteristikou chemického prvku, píše se vlevo nahoru.
Klidová hmotnost: ma - velikost hmotnosti tělesa, kterou naměří pozorovatel, vůči němuž je těleso v klidu. Uvádí se hlavně u elementárních částic, kde se často klidová hmotnost značně liší od hmotnosti pozorované.
Atomová hmotnostní konstanta(v tab. jako hmotnost nukleonů): = 1/12 klidové hmotnosti nuklidu uhlíku (nuklid = atomy se stejným protonovým i nukleovým číslem)
Relativní atomová hmotnost: (vzadu v tab. )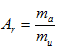
Užívá se ke zjištění ma, uvést několik AR prvků z tabulek
Relativní molekulová hmotnost: ![]() , kde
mm je klidová hmotnost molekuly. Je součtem AR
atomů v molekule.
, kde
mm je klidová hmotnost molekuly. Je součtem AR
atomů v molekule.
Látkové množství: ![]() , kde
N je počet částic v daném tělese. Je to poměr počtu částic
látky k počtu částic v 12g C 12
, kde
N je počet částic v daném tělese. Je to poměr počtu částic
látky k počtu částic v 12g C 12
Soustava, která obsahuje právě tolik částic (např. atomů, molekul, iontů), kolik je atomů nuklidu uhlíku o celkové hmotnosti 12g, má látkové množství 1 mol.
Avogadrova konstanta: ![]() mol-1 – udává počet atomů ve 12 g , nebo počet
částic v tělese o látkovém množství 1 mol.
mol-1 – udává počet atomů ve 12 g , nebo počet
částic v tělese o látkovém množství 1 mol.
Molární hmotnost:![]()
Hmotnost jedné částice: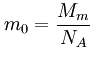


 David se informační technologie naučil na
David se informační technologie naučil na