Struktura, vlastnosti a změny skupenství pevných látek
Pevné látky
a) krystalické - pravidelné uspořádání stavebních částic
monokrystaly - mají pravidelné uspořádání v celém krystalu
(NaCl, CaCO3, SiO2)
polykrystaly – obsahují nahodile uspořádaná zrna, která jsou uvnitř pravidelně uspořádána. (zemina, prach, kovy), jsou izotropní
b) amorfní - beztvaré (asfalt, vosk, sklo, kaučuk)
polymery - bílkoviny, org. původ
izotropie- ve všech směrech má látka stejné vlastnosti (polykrystalické látky)
anizotropie - nejsou stejné vlastnosti (monokrystalické látky)
geometrická mřížka - soustava rovnoběžek v prostoru, rozdělí krystal na soustavu rovnoběžnostěnů
ideální geometrická mřížka je mřížka pravidelně obsazená částicemi
- podle tvarů rovnoběžnostěnů rozlišujeme tzv. krystalografické soustavy - soustava krychlová (kubická) - elementární (základní) buňka je krychle
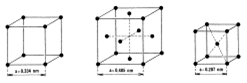
1) primární 2) plošně centrovaná 3) prostorově centrovaná
Vrcholy středy stran střed krychle
- Částice kmitají kolem bodů kryst. mřížky.
mřížkový parametr a- délka hrany krychle
Poruchy (defekty) krystalové mřížky
- v reálném krystalu existuje mnoho poruch od pravidelného
uspořádání částic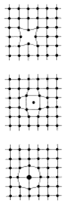
a) vakance - vzniká neobsazením rovnovážné polohy kryst. mřížky
příčina- tepelný kmitavý pohyb částic -> částice opustí své místo a vzniká neobsazené místo
dostaneme ozářením krystalu - elektrony, neutrony, ionty
b) intersticiální poloha - částice se nachází mimo pravidelný bod krystalické mřížky (v mezeře - )
c) příměsy (nečistota)
- cizí částice se vyskytuje v krystalu daného chem. složení
- nachází se buď v intersticiální poloze (podle počtu částic C v Fe dostaneme různé druhy oceli) nebo nahrazuje vlastní částici mřížky (polovodiče typu P nebo N – příměsi do struktury křemíku)
Typy vazeb
Síly které působí mezi částicemi v krystalické mřížce:
1. Iontová – mřížku drží pohromadě elektrické přitažlivé síly mezi kationty a anionty
2. Kovová – odpudivé elektrické síly kationtů kovu nepustí atomy na novou polohu, elektrony tvoří elektronový plyn mezi kationty – jsou volné
3. Kovalentní – je to chemická vazba mezi atomy, kdy atomy mají společné valenční elektrony; je u izolantů nebo polovodičů (Si, Ge)
4. Molekulová – síly mezi molekulami – je velmi slabá
Deformace pevného tělesa
tvárná (plastická) - přestaneme-li působit silou, deformace zůstává
pružná (elastická) - vrací se do původního tvaru, je dočasná
deformace tělesa = změna tvaru, objemu i rozměrů působením vnější síly
a) deformace tahem![]()
F = -F
- roztahování - výtah jeřáb
b) deformace tlakem ![]()
F = -F
- stlačování - pilíře, nosníky
c) deformace ohybem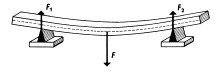
F - síla, působící vahou toho tělesa
- horní vrstva se deformuje tlakem
- spodní vrstva se deformuje tlakem
- prostřední část zůstává nezměněna
d) deformace smykem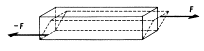
- posunutí vrstev, vzdálenost vrstev se nemění (šroub, nýt)
e) deformace kroucením - obsahuje 2 soustavy sil, vrták
při vrtání, šrouby při utahování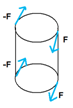
Síla pružnosti, normálové napětí
- tahové síly vyvolávající sílu F
- při deformaci nastává tzv. stav napjatosti, který je charakterizován normálovým napětím - Sigma n [Pa]
![]() síla pružnosti, která působí na příčný řez o obsahu S/ obsah plochy
(v tab u Hoodova zákona na konci F / S)
síla pružnosti, která působí na příčný řez o obsahu S/ obsah plochy
(v tab u Hoodova zákona na konci F / S)
(Fp = m g)
- ve stavu rovnováhy : F = -F
mez pevnosti - sp, sp < Sigma n ==> poruší se soudržnost (přetrhnutí)
→ tab. str. 139
– křehké látky mají mez pevnosti blízko meze pružnosti (sklo)
mez pružnosti (elasticity) - sE - max. hodnota Sigma n, kdy zůstává deformace pružná (pak už trvalá)
dovolené napětí - sD - max. hodnota Sigma n, kdy při deformaci (tahem, tlakem) jde o pružnou deformaci. Podíl meze pevnosti a dovoleného napětí je součinitel (koeficient) bezpečnosti.
Př.:
d=?
m = 2,5t
Sigma n = 60 MPa
Sigma n = mg / pi d2 / 4
d2 = 4 mg / pi Sigma n = 2,3 cm
Př.: SIgma n = ? [Pa]
F = 0,25 kN
d = 2,1mm
Sigma n = Fp / s
Př.:
d = 15mm = 0,015m
(tyčinka)
F = 1,63 * 105 N..... síla potřebná k jejímu přetržení
Urči mez pevnosti v tahu.
Sigma n = Fp / S
Sigma n = 163000 / pi r2 = 163000 / 0,000176625 = 922 859 165 Pa
Hookův zákon pro pružnou deformaci tahem
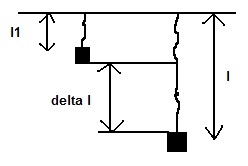
- vyjadřujeme závislost normálového napětí sn a relativního prodloužení epsilon ε
Sigma n = Fp / s
![]()
v tab je, ale není popsát jako ε =!!!
delta l = l - l1 (konečná délka - počáteční délka)
=> prodloužení vůči původní délce. Pokud chceme v procentech, tak ε * 100
Hookův zákon zní: normálové napětí je přímo úměrné relativnímu prodloužení:
Sigma n = E * ε
E... modul pružnosti v tahu (konstanta charakterizuje látku)
- hookův zákon platí pouze pro pružnou deformaci tahem
- je-li E malé, normálové napětí se mění pomalu
ε = 1... prodloužení o vlastní délku
Graf relativního prodloužení:
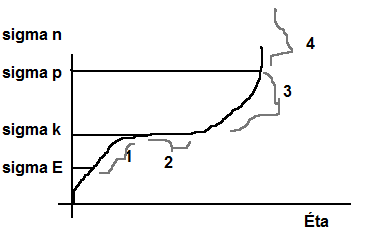
sigma K - mez kluzu
1 - dopružení
2 - látka teče
3 - zpevnění materiálu
4 - roztržení materiálu
- různé materiály mají různé délky částí
Délková, objemová roztažnost
V = V1 [1 + Beta (t - t1)]
- u délkové roztažnosti místo V1 je l1, místo beta je alpha, místo V je l
Beta... součinitel objemové roztažnosti
Aplha... ... součinitel délkové roztažnosti
př.: Ocelový drát má při t2=-15C délku 1000m. Urči jeho délku při teplotě 45C
alpha = 11,5 * 10−6 K
l - 1000 * [1 + 11,5 * 10−6 * 60]
l = 1000 * [1 + 690 * 10−6]
l = 1000 * [1,00069] = 1000,7 m
př.: t1 = 20C
V1 = 1 l
delta V = ?
t = 80C
1l = dm3 = 0,001 m3
Beta = 2,4 * 10−5 K−1
V = 0,001 [1 + 2,4 * 10−5 (60)]
V = 0,001 * 1,00144
V = 0,00100144 m3
deltaV = 0,001 - 0,00100144
deltaV = 0,00000144 m3
deltaV = 1,44 cm3
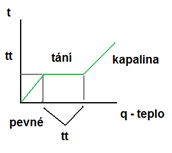
Proces tání
- změna skupenství pevného na kapalné
- většina pevných látek procesem tání zvětšuje svůj objem
- výjimky: led, bismut, germanium - ty táním svůj objem zmenšují
Podmínky uskutečnění tání
a) dosažení teploty tání tt (různá, souvisí s vnějším tlakem)
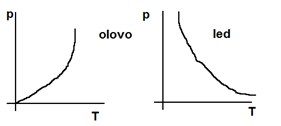
- u ledu se zvyšující teplotou tlak snižuje -> regulace ledu
b) musíme dodávat teplo, než těleso roztaje -> skupenské teplo tání Lt [J] = teplo, které musíme dodat tělesu, zahřátému na teplotu tání Lt, aby se roztálo
Q = m c delta t
c... měrná tepelná kapacita
př.: Q = ? [J]
m = 10 kg
t1 = 20 C
tt = 660 C
c = 896 J kg−1 K−1
lt = 400 K J kg−1
Q1 = m c delta t
Lt = m lt
Q = Q1 + Lt
Q = 10 * 896 * 640 + 10 * 400 000
Q = 57344 * 102 + 4 * 106
Q = 94 344
Př.:
ε = 62% = 0,62
M = 5 t = 5 * 103 kg
E = ?
T1 = 16 C
Tt = 1300 C
C = 460 J kg−1 K−1
Lt = 82 kJ kg−1 = 82 * 103 J kg−1 K−1
ε = Q / E
E = Q / ε
Q = Qz + lt
Q = m c (t1 - 1) + m * lt
Q = 5 * 103 * 460 * (1300 - 16) + 5 * 103 * 82 * 103
Q = 5 * 104 * 46 * (1284) + 5 * 106 * 82
Q = 23 * 105 * 1284 + 41 * 107
Q = 29532 * 105 + 41 * 107 = 33632 * 1-^5 J
Vypařování (koncenzace)
- přeměna kapaliny na plyn
- Probíhá za každé teploty
Urychlíme:
- Zvýšením teploty
- Odvodem par
- Zvětšení plochy
- Skupenské teplo vypařování (varu) - Lv
- Množství tepla, které musíme dodat, aby se látka změnila v páru téže teploty.
– měrné skupenské teplo vypařování (také Lv)
Lv = Lv / m [J Kg−1]
- Lv s rostoucí teplotou klesá
Př.: voda 0C à lv = 2,51 MJ kg−1 … tab. 152
100C à lv = 2,26 MJ kg−1
Var – proces, kdy k vypařování dochází v celém objemu kapaliny (vypařování odevšud)
- Bublinky páry vznikají uvnitř kapaliny
- Je podmíněn teplotou varu
Např.: H2O při normál. atmosférickém tlaku 101 kPa má teplotu varu 100 C
- Teplota varu závisí na vnějším tlaku
- S rostoucím tlakem teplota varu roste, se snižujícím klesá
- Využití: v tlakových nádobách – papinův hrnec
Sublimace
- Proces, při kterém se pevná látka přímo mění na plyn
- Sublimuje např.: sníh, led, jód, kafr, naftalen, ale i vonící a páchnoucí pevné látky
- Měrné skupenské teplo sublimace ls = Ls / m
- Ls závisí na teplotě, kdy látka sublimuje
Desublimace
- Přeměna látky z plynného stavu na pevné. Např. jinovatka, kdy vodní pára nesublimuje na pevné krystalky při teplotách menších, než 0C
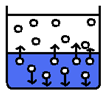
Sytá pára
- Vzniká v uzavřené nádobě
- Prostor nad kapalinou se zasytí (obsahuje maximální možný počet molekul plynu)
- V uzavřené nádobě dochází k dynamické rovnováze à objem syté páry a kapaliny je stejný
Vlastnosti syté páry
- Je v rovnováze s kapalinou
- Neplatí Van der Walsova rovnice ani stavová rovnice (p * V / T – není konstantní)
- Tlak syté páry se při konstantní teplotě nemění s objemem
- Při rostoucí teplotě se tlak syté páry zvyšuje
- Tlak syté páry závisí pouze na chemickém složení
Vlhkost vzduchu
Absolutní vlhkost:
Ф = m / V
– udává hmotnost páry v určitém objemu.
Relativní vlhkost:
fí = Ф / Фm
Podíl absolutní vlhkosti / vlhkostí, kdy je vodní pára ve vzduchu sytou parou
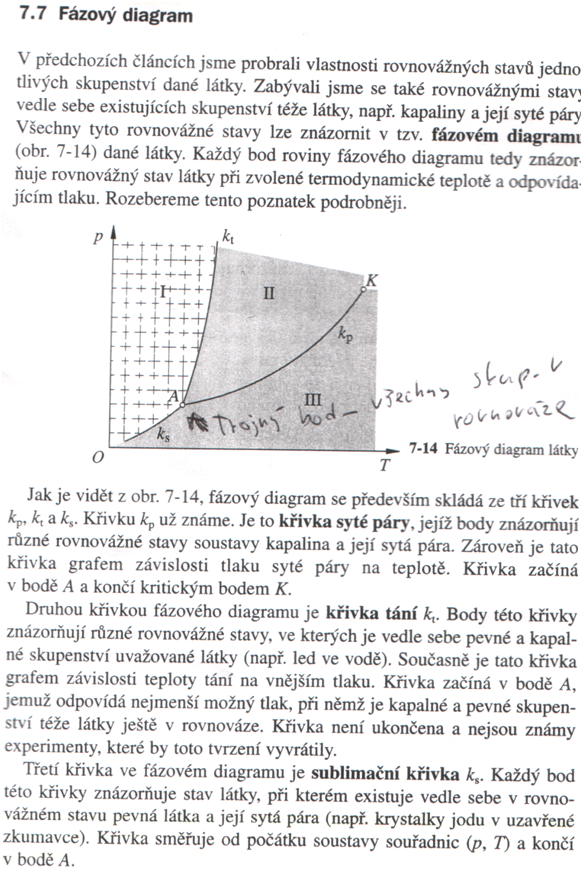
A….trojný bod à je to stav, kdy pevná látka, kapalina i plynná látka jsou v dynamické rovnováze
K … kritický bod à je to poslední bod křivky, ve kterém jde určit, zda se jedná o plynnou látku nebo kapalinu


 David se informační technologie naučil na
David se informační technologie naučil na