Elektrický proud v kapalinách a plynech
Základy o elektrickém proudu – viz otázka 15.
- nakreslit 3 obrázky složení molekul v pevných, kapalných a plynných látkách + vysvětlit, proč je v plynech nejobtížnější vést el. proud
Vedení el. proudu v kapalinách
Většina kapalin v čistém stavu jsou izolanty
elektrolyt - sloučenina, která obsahuje volné ionty (např. NaCl), které se mohou pohybovat a vést el. proud (př. vodné roztoky kyselin, zásad a solí)
elektrolytická disociace - Při rozpouštění kyselin, solí a zásad ve vodě dochází ke vzniku iontů působením molekul rozpouštědla (vody). Je to děj, při kterém rozdělíme látku na jednotlivé ionty.
elektrolýza - děj, kdy kladné kationty putují ke
katodě (záporná elektroda) a záporné anionty putují k anodě (kladná 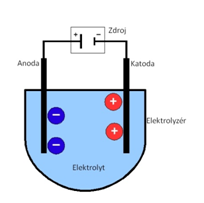 elektroda) a mění se tím na neutrální atomy. Děj
vyvoláme připojením el. zdroje k elektrodám. El. pole, které vznikne mezi
elektrodami, vyvolá usměrněný pohyb iontů. Vyloučené látky mohou
reagovat s elektrodami nebo s elektrolytem.
elektroda) a mění se tím na neutrální atomy. Děj
vyvoláme připojením el. zdroje k elektrodám. El. pole, které vznikne mezi
elektrodami, vyvolá usměrněný pohyb iontů. Vyloučené látky mohou
reagovat s elektrodami nebo s elektrolytem.
- slouží k pokovování, aby materiály déle vydržely (je alternativou ochranného laku), nebo se využívá v bateriích (olověných) a v čištění kovů - vyplaví příměsi
To, jestli bude elektrolýza probíhat, závisí na napětí zdroje. Napětí musí disociovat látky, až potom může obvodem procházet proud. Pro proud, který prochází elektrolytem platí:
![]() -
není v tab
-
není v tab
Ur je rozkladné napětí.
Čím větší je vzdálenost elektrod, tím větší je odpor Þ klesá proud. Čím víc jsou elektrody ponořené do elektrolytu, tím větší je proud (větší účinná plocha).
- voltampérová charakteristika elektrolytického vodiče:
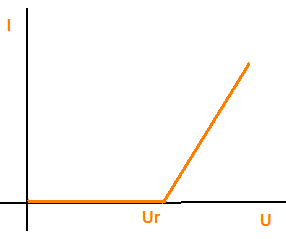
Ur.... polarizační (rozkladné) napětí
Odpor elektrolýzy závisí:
1) na vzdálenosti elektrod
2) na ponoření elektrod
3) na teplotě
Faradayovy zákony pro elektrolýzu
Katoda - Při elektrolýze se vždy vylučuje kov nebo vodík.
Anoda - složitější – mohou se na ní též vylučovat různé látky, může ale docházet také k rozpouštění anody.
Každá vyloučená molekula přijme z katody a odevzdá anodě několik elektronů. K vyloučení jedné molekuly na katodě musí tedy ionty přijmout n elementárních nábojů e – jedna molekula se vyloučí nábojem
n… oxidační číslo (počet klad/záporných částic)
Q = n × e (Q = N * e) – oba nejsou v tab!
Pro Na+ nebo Cl– je n = 1; pro Cu2+ nebo O2– je n = 2 → Pro každý iont platí Xn+ nebo Xn–
Projde-li povrchem elektrody celkový náboj Q = I × t, je počet vyloučených molekul
![]()
Vynásobíme-li toto číslo hmotností jedné molekuly
m0= Mm/NA
(Mm – molární hmotnost vyloučené látky, NA – Avogadrova konstanta = 6,022 × 1023)
dostaneme celkovou hmotnost vyloučené látky:
![]()
F = NA × e – Faradayova konstanta (udává náboj, kterým se vyloučí 1 mol jednomocného prvku): F = 9,65.104 C × mol–1
Odvozený vztah vyjadřuje zákony, které Faraday objevil v roce 1833:
1. Faradayův zákon:
Hmotnost m vyloučené látky je přímo úměrná náboji Q, který prošel elektrolytem:
m = A × Q = A × I × t
A – elektrochemický ekvivalent, jednotka kg × C–1
Udává množství látky vyloučené proudem 1 A za 1 s Þ definice ampéru:
Proud 1 A vyloučí za 1 s 1,118 g stříbra.
2. Faradayův zákon:
Elektrochemický ekvivalent látky vypočteme, jestliže její molární hmotnost vydělíme Faradayovou konstantou a počtem elektronů potřebných k vyloučení jedné molekuly.
![]()
Elektrolýzy se využívá v metalurgii, při galvanickém pokovování, v galvanoplastice atd.
Galvanické články
- tvořený dvěma elektrodami z různých kovů, mezi kterými je umístěna vodivá kapalina – elektrolyt. Využívá chemickou energii uvolněnou při reakci kovových elektrod s elektrolytem, která se přeměňuje na energii elektrickou.
- Voltův článek – elektrody – Zn, Cu; elektrolyt – zředěná H2SO4
- Suchý článek (monočlánek) – elektrody – Zn, C + směs grafitu a burelu; elektrolyt – roztok salmiaku zahuštěný na gel (např přídavkem škrobu); baterie = spojení více monočlánků
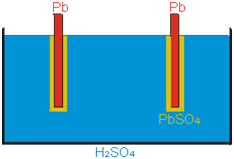
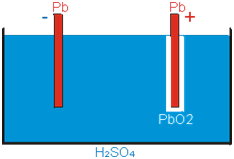
- Akumulátor - je zařízení, založené na vzniku elektrolyt. potenciálů, schopnost akumulovat náboj nám vyjadřuje kapacita. Nejčastější jsou olověné akumulátory. Na katodě redukcí vzniká čisté olovo a na anodě oxidací oxid olovičitý.
Můžeme ho nabíjet; elektrolyt – zředěná H2SO4 → v autech, dále např. NiCd, NiMH, Li-ion (pro elektronické účely – články do walkmanů, přenosných CD, MD přehrávačů, mobilních telefonů)
|
|
|
Vybitý – elektrody jsou pokryty H2SO4 Nabitý – Olověné elektrody, anoda pokryta PbO2
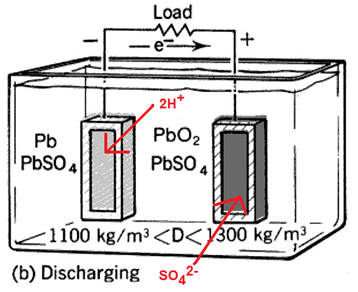
Kapacita baterie [Ah] – Kapacitu 1AH má baterie, která je schopná dodávat I 1A po 1 hod.
Elektrický proud v plynech
- plyny jsou za běžných podmínek (20 C, 101 kPa) izolanty, protože obsahují neutrální molekuly, jejich vedení zajistíme ionizací.
- ionizace - děj, při kterém vnějším zásahem docílíme uvolnění elektronů z molekuly (zbytek molekul se chová jako kladně nabité částice - kation). Uvolněné elektrony se mohou připojovat k neutrálním molekulám a vytvářet tak anionty.
ionizační energie – Energie potřebná k rozštěpení molekuly [elektronvoltech (1 eV = 1,6 × 10–19 J)] – tab, vzadu.
Současně s ionizací probíhá v plynu i opačný děj, zvaný rekombinace. Nesouhlasně nabité částice se přitahují a vytvářejí opět neutrální molekuly.
- prostředek pro ionizaci nazýváme ionizátor. Aby se elektrony uvolnily, musíme dodat energii - různé druhy záření (UV), zahřátí plynu na vysokou teplotu, ionty nebo elektrony urychlené el. polem.
Ionizace nárazem
- při dostatečné energii se elektron uvolní z obalu a dokáže nárazem na jinou molekulu uvolnit další elektrony (lavinová)
Pokud se ionizovaný plyn nachází v el. poli mezi dvěma elektrodami, vznikne el. proud jako uspořádaný pohyb kationtů k záporně nabité katodě, aniontů a elektronů ke kladně nabité anodě (ionty, které dorazí na elektrody, ztrácejí svůj náboj a mění se v neutrální molekuly)..
Elektrický proud v plynech se nazývá elektrický výboj a je doprovázen světelnými a zvukovými efekty)
dělíme na: samostatný a nesamostatný
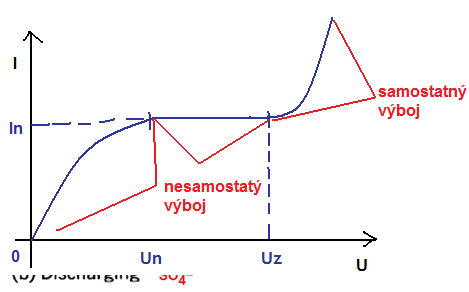
In = nasycený proud, při určité hodnotě napětí se proud nezvyšuje, protože všechny volné částice jsou zachyceny na elektrodách, již neplatí ohmův zákon.
Uz - zápalné napětí, dochází k ionizaci nárazem
Pokud je U < Un, zanikne většina iontů rekombinací dříve, než dorazí na elektrody
U < Uz - nesamostatný výboj – el. proud prochází pouze za přítomnosti vnějšího ionizátoru; přestane-li ionizátor působit, převládne rekombinace nad ionizací a výboj ustává
U > Uz... napětí se lavinovitě zvětšuje, ionizace převládá nad rekombinací a proud roste. Není potřeba vnější ionizátor, ionty vznikají samovolně -> SAMOSTATNÝ VÝBOJ
Ionty a elektrony jsou urychleny el. polem natolik, že při nárazu na neutrální molekulu ji ionizují. Počet ionizovaných molekul v plynu lavinovitě narůstá a proto narůstá velmi rychle i proud. Plyn vede proud bez přítomnosti ionizátoru.
Velikost Uz závisí na tlaku plynu a na druhu plynu, za nižšího tlaku zápalné napětí menší.
plazma = vysoce ionizovaný plyn
Výboj za atmosférického tlaku
1) Obloukový výboj - doprovázen vysokými teplotami, velkým proudem a malým Uz, dlouhodobé výboje, velká intenzita záření (obloukové sváření, lampy, horské slunce, vysokotlaké rtuťové výbojky)
2) Jiskrový výboj - velký proud, krátkodobé výboje, při kterých dochází k jednorázovému vybití potenciálů (blesk, spalovací motory - svíčka). K ochraně před ničivými účinky blesku slouží bleskosvod (= kovová tyč vodivě spojená se zemí, Prokop Diviš)
3) koróna (keříčkový výboj) - vzniká v nehomogenním poli, kolem hrotů, rohů, drátů, velká intenzita. př. koróna způsobuje ztráty na vedeních vysokého napětí za sníženého tlaku (nižší zápalné napětí):
4) Doutnavý výboj
ve výbojce = skleněná trubice, která obsahuje plyn o tlaku menším, než je tlak atmosférický
– projevuje se svícením, má poměrně nízké Uz a nízký proud, nespotřebovává velké množství el. energie
- u katody - katodové doutnavé světlo - využívá se v krátkých výbojkách = doutnavky (využití jako indikátor napětí / polarity)
- u anody - anodový sloupec - využívá se v reklamních trubicích a zářivkách
zářivka - výbojka plněná směsí plynu argonu a par rtuti. Při výboji vzniká UV záření, které dopadá na stěny výbojky, které jsou pokryty oxidy kovů a způsobují světelkování (lumiflor).
Katodové záření vzniká při tlaku menším, než 2Pa a při vysokém napětí
Katodové záření
- tok elektronů emitovaných přímo z katody
vlastnosti:
1) šíří se přímočaře
2) vychyluje se v magnet. a elektr. poli
3) způsobuje při kontaktu s látkou světélkování
4) proniká tenkými materiály a rozptyluje se
užití: v obrazovkách - osciloskop (paprsek řízen el. polem), televize (paprsek řízen mag. polem)



 David se informační technologie naučil na
David se informační technologie naučil na